來(lái)源:網(wǎng)絡(luò)資源 2022-11-14 20:57:05
溶液的酸堿性
一、酸性溶液和堿性溶液
1.酸性溶液、堿性溶液和指示劑的反應(yīng):
| 實(shí)驗(yàn)試樣 | 白醋 | 酸果汁 | 稀鹽酸 | 純堿溶液 | 肥皂水 | 石灰水 | 氨水 | 食鹽水 | 蔗糖水 |
| 滴加紫色石蕊試液 | 變紅 | 變紅 | 變紅 | 變藍(lán) | 變藍(lán) | 變藍(lán) | 變藍(lán) | 紫色 | 紫色 |
| 滴加無(wú)色酚酞試液 | 無(wú)色 | 無(wú)色 | 無(wú)色 | 變紅 | 變紅 | 變紅 | 變紅 | 無(wú)色 | 無(wú)色 |
| 結(jié)論 | 酸性 | 酸性 | 酸性 | 堿性 | 堿性 | 堿性 | 堿性 | 中性 | 中性 |
結(jié)論:
(1)凡是能使紫色石蕊試液變紅的溶液都是酸性溶液,且該溶液不能使無(wú)色酚酞試液變色;
(2)凡是能使紫色石蕊試液變藍(lán)的溶液都是堿性溶液,并且該溶液能使無(wú)色酚酞試液變紅;
(3)不能使紫色石蕊試液變色,也不能使無(wú)色酚酞試液變色的溶液,我們稱為中性溶液;
(4)紫色石蕊試液和酚酞能檢驗(yàn)溶液酸堿性的試劑,我們稱為酸堿指示劑。
注意:
①酸性溶液能使藍(lán)色石蕊試紙變紅,堿性溶液能使紅色石蕊試紙變藍(lán);
②只有可溶性的酸性、堿性物質(zhì)才能使指示劑變色,變色的是指示劑,而不是該物質(zhì),而且這酸堿和指示劑的反應(yīng)屬于化學(xué)變化。
2.日常生活中常見(jiàn)的酸性物質(zhì)與堿性物質(zhì)
(1)酸性物質(zhì):山楂、檸檬、柑橘、西紅柿,食醋等;
(2)堿性物質(zhì):熟石灰,碳酸鈉等。
3.區(qū)分酸溶液和酸性溶液、堿溶液和堿性溶液
注意:酸溶液是指酸的水溶液,酸性溶液是指能使紫色石蕊試液變紅的溶液,因此酸溶液一定是酸性溶液,而酸性溶液不一定是酸溶液;同樣,堿性溶液不一定是堿溶液,堿溶液一定是堿性溶液。
例如:硫酸銅、氯化銨,硫酸氫鈉的水溶液顯酸性,而不是酸;純堿、肥皂的水溶液顯堿性,但不是堿。
4.酸、堿、鹽的概念
(1)酸:電離時(shí)生成的陽(yáng)離子全部是氫離子的化合物。如:HCl、HNO3、H2SO4、H2CO3等。
HCl= H+ + Cl-(一元酸);H2SO4= 2H++SO42-(二元酸);
(2)堿:電離時(shí)生成的陰離子全部是氫氧根離子的化合物。如:NaOH、Ca(OH)2等。
NaOH = Na+ + OH-(一元堿);Ca(OH)2 = Ca2+ + 2OH-(二元堿);
(3)鹽:電離時(shí)生成金屬離子(或銨根離子)和酸根離子的化合物。如:NaCl、NH4NO3等。
NaCl = Na+ + Cl-; NH4NO3 = NH4+ + NO3-;
二、溶液的酸堿性的強(qiáng)弱
1.酸堿度:用來(lái)表示溶液的酸性或堿性的強(qiáng)弱程度。
2.pH試紙用來(lái)定量的測(cè)定溶液的酸堿度。

酸性增強(qiáng) 中性 堿性增強(qiáng)
溶液的pH值與酸堿性關(guān)系:
pH=7,溶液呈中性;
pH<7,溶液呈酸性,且pH越小,酸性越強(qiáng);
pH>7,溶液呈堿性,且pH越大,堿性越強(qiáng)。
3.pH試紙的使用方法:
用玻璃棒蘸取待測(cè)溶液,滴在PH試紙上,顯色后對(duì)照標(biāo)準(zhǔn)比色卡,讀出讀數(shù)。
注意:
(1)不能直接把pH試紙浸入待測(cè)溶液中;
(2)不能先用水將pH試紙潤(rùn)濕,再進(jìn)行測(cè)試,因?yàn)樗疂?rùn)濕后的pH試紙?jiān)俚稳氪郎y(cè)液相當(dāng)于被稀釋;
(3)實(shí)驗(yàn)室使用的pH試紙是廣泛pH試紙,測(cè)出的pH值是1~14的整數(shù);
三、溶液酸堿性與生命活動(dòng)的關(guān)系
1.人的體液有一定的酸堿度。血液、組織間液和細(xì)胞內(nèi)液的酸堿度都接近于中性,而且變化極小;
2.胃液的pH在0.9~1.5之間,胃液的主要成分是鹽酸HCl;
3.大多數(shù)農(nóng)作物適宜在接近中性(pH在6.5~7.5之間)的土壤中生長(zhǎng),在改良酸性土壤時(shí),我們一般是使用熟石灰來(lái)調(diào)節(jié)其酸堿度;
4.雨水一般呈略酸性(由于空氣中的二氧化碳溶解在雨水中),正常雨水的PH≈5.6,人們一般把pH小于5.6 的雨水稱為酸雨。
■常見(jiàn)的酸和堿
一、常見(jiàn)的酸
1.生活中常用的酸:胃液中含有的鹽酸(HCl),蓄電池中含有硫酸(H2SO4),酸雨中含有的硫酸及硝酸(HNO3),食醋中含有的醋酸(CH3COOH);飲料中可能含有的碳酸、檸檬酸等。
2.濃硫酸、濃鹽酸和濃硝酸的物理性質(zhì)
| 濃硫酸 | 濃鹽酸 | 濃硝酸 | |
| 溶質(zhì)的化學(xué)式 | H2SO4 | HCl | HNO3 |
| 顏色 | 無(wú)色 | 無(wú)色 | 無(wú)色 |
| 狀態(tài) | 粘稠、油狀液體 | 液體 | 液體 |
| 氣味 | 無(wú)味 | 刺激性氣味 | 刺激性氣味 |
| 濃度 | 98% | 36%~37% | 70% |
| 密度(與水比較) | 1.84g/mL | 1.17g/mL | 1.42g/mL |
| 敞開(kāi)試劑瓶口發(fā)生的現(xiàn)象 | 無(wú)明顯現(xiàn)象 | 產(chǎn)生白霧 | 產(chǎn)生白霧 |
| 是否具有揮發(fā)性 | 不易揮發(fā) | 有揮發(fā)性 | 有揮發(fā)性 |
| 與水混合 | 放出大量的熱 | 無(wú)明顯放熱 | 無(wú)明顯放熱 |
| 露置在空氣中后的溶液質(zhì)量 | 變大 | 變小 | 變小 |
| 露置在空氣中后的溶質(zhì)質(zhì)量 | 不變 | 變小 | 變小 |
| 露置在空氣中后的溶劑質(zhì)量 | 變大 | 不變 | 不變 |
| 露置在空氣中后的質(zhì)量分?jǐn)?shù) | 變小 | 變小 | 變小 |
注意:濃硫酸具有一定的特性:
(1)吸水性(物理性質(zhì))用于氣體干燥,但除NH3等堿性氣體除外,對(duì)應(yīng)的化學(xué)方程式為:2NH3 + H2SO4 ==(NH4)2SO4;
(2)脫水性(化學(xué)性質(zhì))—濃硫酸與蔗糖反應(yīng),使之炭化;
(3)強(qiáng)氧化性,腐蝕性——與金屬發(fā)生反應(yīng),生成的氣體不生成氫氣而是二氧化硫。
在信息題目中個(gè),有時(shí)候我們會(huì)遇到這樣的題目:在加熱的條件下,能與排在氫后面的金屬(如Cu)反應(yīng),如:
![]()
(4)濃硫酸的稀釋:酸入水,沿器壁,攪拌。
濃硫酸溶于水放出大量的熱,可以使水分沸騰。如果把水倒入濃硫酸中,水就會(huì)浮在濃硫酸上面,溶解時(shí)放出大量的熱致使水沸騰而使硫酸液滴向四周飛濺。
(5)安全事故處理:濃硫酸濺到皮膚上后,首先迅速用抹布將其擦拭,然后用大量水沖洗,最后用3%~5%的NaHCO3涂敷。
4.酸的化學(xué)性質(zhì)
(1)實(shí)驗(yàn):稀硫酸、稀鹽酸、稀硝酸化學(xué)性質(zhì)的比較
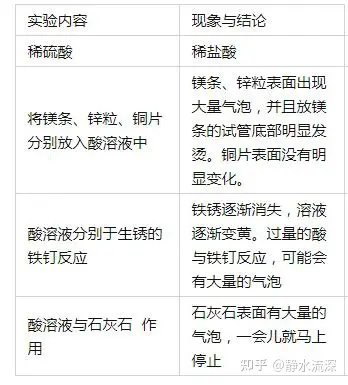
總結(jié):
酸所具有的共同特點(diǎn):(酸在水溶液中都能電離出氫離子,故酸溶液會(huì)具有許多共同的性質(zhì)。)
二、酸的通性(5條):
(1)酸溶液與酸堿指示劑的反應(yīng)
A.紫色石蕊試液遇到酸溶液變紅色;
B.無(wú)色酚酞試劑遇到酸溶液不變色。
(2)酸+金屬=鹽+氫氣(置換反應(yīng))
酸溶液 + (氫前)金屬 → 鹽溶液 + 氫氣
注意:
A.在金屬活動(dòng)性順序表中,排在氫前面的金屬能置換出酸中的氫,排在氫后面的金屬則不能;
B.排在金屬活動(dòng)性順序表越前面的金屬,反應(yīng)現(xiàn)象越劇烈,速度越快,如Mg反應(yīng)有明顯放
熱現(xiàn)象;
C.強(qiáng)氧化性酸與金屬反應(yīng)后,不能生成氫氣,而是生成水。如濃硫酸、硝酸等強(qiáng)氧化性酸;
D.該類反應(yīng)屬于置換反應(yīng),如:
Zn + 2HCl = ZnCl2 + H2↑;
Fe + H2SO4 = FeSO4 + H2↑ .
(3)酸+金屬氧化物=鹽+水(金屬氧化物又稱堿性氧化物,屬于復(fù)分解反應(yīng))
該反應(yīng)過(guò)程中,金屬元素的化合價(jià)不變,酸中的原子團(tuán)不變, 如:
CuO + 2HCl = CuCl2 + H2O;
Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O;
ZnO + 2HNO3 == Zn(NO3)2+H2O;
在一些資料以及考試題目當(dāng)中,也有先關(guān)的知識(shí),可以提前了解:
| 酸性氧化物 | 堿性氧化物 | |
| 定義 | 凡能與堿反應(yīng)生成鹽和水的氧化物大多數(shù)非金屬氧化物是酸性氧化物大多數(shù)酸性氧化物是非金屬氧化物。 | 凡能與酸反應(yīng)生成鹽和水的氧化物大多數(shù)金屬氧化物是堿性氧化物所有堿性氧化物是金屬氧化物。 |
| 化學(xué)性質(zhì) |
大多數(shù)可與水反應(yīng)生成酸:CO2+H2O= H2CO3; SO2+H2O= H2SO3; SO3+H2O= H2SO4. |
少數(shù)可與水反應(yīng)生成堿:Na2O+H2O=2NaOH;K2O+H2O=2KOH;BaO+H2O=Ba(OH)2;CaO+H2O==Ca(OH)2. |
| 酸性氧化物+堿→鹽+水CO2+Ca(OH)2=CaCO3↓+H2O (不是復(fù)分解反應(yīng)) | 堿性氧化物+酸→鹽+水Fe2O3+6HCl=2FeCl3+3H2O(是復(fù)分解反應(yīng)) |
(4) 酸 + 堿= 鹽 + 水(又稱為中和反應(yīng),反應(yīng)類型:復(fù)分解反應(yīng))
注意:有鹽和水的生成不一定是中和反應(yīng),如CO2+Ca(OH)2=CaCO3↓+H2O ;
(5)酸+鹽=新酸+新鹽
注意:
A.我們通常遇到的鹽是碳酸鹽,因此絕大部分反應(yīng)是:
酸 + 碳酸鹽 =新鹽 + 水 + 二氧化碳,依然是復(fù)分解反應(yīng);
如:
CaCO3 + 2HCl =CaCl2 + H2O + CO2↑;
Na2CO3 + H2SO4 =Na2SO4 + H2O + CO2↑;
K2CO3 + 2HNO3 =2KNO3 + H2O + CO2↑;
MgCO3 + 2CH3COOH = (CH3COO)2Mg + H2O + CO2↑;
B.某些特殊的鹽能與酸反應(yīng),生成特殊的沉淀,需要記憶沉淀
如:
HCl + AgNO3 == AgCl↓+ HNO3 ;
BaCl2 + H2SO4 == BaSO4↓+ 2HCl.
補(bǔ)充: Cl-及SO42-的檢驗(yàn)
A.向待測(cè)溶液中加入AgNO3溶液后有白色沉淀生成,滴入稀硝酸溶液后,沉淀不消失,則溶液中含有Cl-,如果沒(méi)有沉淀或者沉淀消失,則不含有Cl-;
B.向待測(cè)溶液中加入Ba(NO3)2溶液后有白色沉淀生成,滴入稀硝酸溶液后,沉淀不消失,則溶液中含有SO42-,如果沒(méi)有沉淀或者沉淀消失,則不含有SO42-。
三、常見(jiàn)的堿
| 實(shí)驗(yàn)內(nèi)容 | 實(shí)驗(yàn)現(xiàn)象 | |||
| 氫氧化鈉、氫氧化鈣、氨水 物理性質(zhì)的比較 | 名稱 | 氫氧化鈉 | 氫氧化鈣 | 氨水 |
| 化學(xué)式 | NaOH | Ca(OH)2 | NH3•H2O | |
| 顏色 | 白色 | 白色 | 無(wú)色 | |
| 狀態(tài) | 片狀固體 | 粉末狀固體 | 液體 | |
| 氣味 | 無(wú)味 | 無(wú)味 | 有氨臭氣味 | |
| 溶解性 | 易溶 | 微溶 | 易溶 | |
| 俗稱 | 燒堿、火堿苛性鈉 | 熟石灰消石灰 | —— | |
| 氫氧化鈉、氨水 露置在空氣中發(fā)生的變化 | 固體氫氧化鈉露置在空氣中,表面出現(xiàn)潮濕,這個(gè)現(xiàn)象稱為潮解。同時(shí)氫氧化鈉也會(huì)吸收空氣中的二氧化碳而質(zhì)變,生成碳酸鈉。氨水露置在空氣中,會(huì)使其溶質(zhì)質(zhì)量分?jǐn)?shù)變小。 | |||
| 燒堿在水中的溶解情況 | 放出大量的熱,水溶液具有滑膩感。 | |||
| 在硫酸銅溶液中滴加石灰水 | 出現(xiàn)藍(lán)色沉淀CuSO4+Ca(OH)2==Cu(OH)2↓+CaSO4↓ |
1.有關(guān)堿的一些性質(zhì)比較
燒堿具有強(qiáng)腐蝕性,氫氧化鈣和氨水也具有一定的腐蝕性。
2.堿的共同性質(zhì)(由于堿電離后都能生成OH-,因此也具有相同的性質(zhì))
四、堿的四大通性:
首先了解,堿的電離,如:
NaOH = Na+ + OH-;
NH3•H2O = NH4+ + OH-(NH3溶于水,滴加酚酞變紅的原因);
(1)與酸堿指示劑作用
A.紫色石蕊試劑遇到堿溶液變藍(lán);
B.無(wú)色酚酞遇到堿溶液變紅。
(2)堿溶液 + 非金屬氧化物 → 鹽 + 水(非金屬氧化物又稱酸性氧化物,該反應(yīng)不是復(fù)分解反應(yīng))
如:
2NaOH + CO2 = Na2CO3 + H2O;
Ca(OH)2 + SO2 = CaSO3↓ + H2O;
(3)堿 + 酸 = 鹽 + 水
(4)堿 + 鹽 = 新鹽 + 新堿
如:
CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2↓;
Ca(OH)2+Na2CO3=2NaOH+CaCO3↓(工業(yè)制堿法,純堿制燒堿);
3.復(fù)分解反應(yīng):有兩種化合物相互交換成分,生成另外兩種化合物的反應(yīng)。
反應(yīng)表達(dá)式:AB + CD =AD + CB 表示。
特點(diǎn):(兩兩交換,價(jià)態(tài)不變)
(1)反應(yīng)物、生成物均只有兩種化合物;
(2)發(fā)生反應(yīng)的兩種化合物相互交換成分;
(3)各元素的化合價(jià)在反應(yīng)前后均不改變。
注:難溶性堿受熱易分解(不屬于堿的通性)
■ 幾種重要的鹽
一、鹽
1.鹽的分類:依據(jù)組成鹽的陽(yáng)離子和酸根的種類進(jìn)行分類
根據(jù)陽(yáng)離子的不同,鹽可以分為鈉鹽、鉀鹽、鎂鹽、鐵鹽、銨鹽等。(氯化鈉為鈉鹽)
根據(jù)酸根的不同,鹽可以分為硫酸鹽、碳酸鹽、硝酸鹽、鹽酸鹽等。(氯化鈉為鹽酸鹽)
2.酸、堿、鹽的溶解性規(guī)律:
①酸都溶;②溶堿有五位:鉀、鈉、銨、鈣、鋇;③鉀鹽、鈉鹽、銨鹽、硝酸鹽都可溶;④鹽酸鹽只有氯化銀不可溶;⑤硫酸鹽只有硫酸鋇不可溶;⑥碳酸鹽只溶鉀、鈉、銨,剩下都不溶。
注意:AgCl、BaSO4不僅不溶于水,而且不溶于稀硝酸。
10種常見(jiàn)沉淀:
AgCl↓、BaSO4↓:不和酸反應(yīng);
以下的沉淀都和酸反應(yīng):
Cu(OH)2↓:藍(lán)色沉淀;
F e(OH)3↓:紅褐色沉淀;
其余的沉淀都是白色:
BaCO3↓、CaCO3↓:和酸反應(yīng),產(chǎn)生氣體,氣體能使澄清石灰水變渾濁;
Zn(OH)2↓、Mg(OH)2↓、Fe(OH)2↓、Al(OH)3;
3.鹽的化學(xué)性質(zhì):
(1)鹽 + 金屬 =新鹽 + 新金屬(置換反應(yīng))
在金屬活動(dòng)性順序表中,除非常活潑的金屬K、Ca、Na之外,排在前面的金屬一般可以將位于其后面的、比它不活潑的金屬?gòu)乃鼈兊柠}溶液中置換出來(lái),如:
Zn + CuSO4 = ZnSO4 + Cu;
Cu + 2AgNO3 = 2Ag + Cu(NO3)2;
(2)鹽+堿 = 新鹽+新堿
如:
CuSO4 + Ca(OH)2 = Cu(OH)2↓ + CaSO4;(CuSO4 和 Ca(OH)2 配置農(nóng)藥波爾多液)
(3)鹽+酸 = 新鹽+新酸
Na2CO3+2HCl ==2NaCl+H2O+CO2↑
■判斷復(fù)分解反應(yīng)發(fā)生的條件:
a.有沉淀生成;
b.有氣體放出;
c.有水生成;
d.如果是沒(méi)有酸參加的反應(yīng),則兩種反應(yīng)物必須都溶于水。
二、幾種常見(jiàn)的鹽
1.氯化鈉(NaCl)
廚房中常見(jiàn)的調(diào)味劑;生理鹽水的成分;農(nóng)業(yè)上用來(lái)選種;做冰雪消融劑。
2.碳酸鈉(Na2CO3)
(1)俗名:純堿、蘇打
(2)純堿不是堿,是鹽(水溶液顯堿性)
(3)用途:玻璃、造紙、紡織和洗滌劑的生產(chǎn)等
(4)Na2CO3+ 2HCl =2NaCl + CO2↑+ H2O(滅火器的原理)
3.碳酸氫鈉(NaHCO3)
(1)俗名:小蘇打
(2)用途:焙制糕點(diǎn);發(fā)酵粉的主要成分、治療胃酸過(guò)多;
(3)NaHCO3+ HCl =NaCl + CO2↑+ H2O .
4.碳酸鈣(CaCO3)
(1)大理石、石灰石、鐘乳石、貝殼、珍珠、蛋殼、鍋爐和水壺的水垢的主要成分
(2)用途:建筑材料、補(bǔ)鈣劑
(3)CaCO3+2HCl===CaCl2+ CO2↑+ H2O;
(4)相對(duì)分子質(zhì)量為100,Ca元素的質(zhì)量分?jǐn)?shù)占40%.
補(bǔ)充:碳酸鹽(CO32-、HCO3-)的檢驗(yàn):
A.向待測(cè)溶液中加入稀HCl后有氣泡生成,將產(chǎn)生的氣體通入澄清石灰水,若澄清石灰
水變渾濁,則溶液中含有CO32-;若澄清石灰水無(wú)變化,則溶液中不含有CO32-。
B.向待測(cè)溶液中加入BaCl2溶液后有白色沉淀生成,滴入稀HCl后,沉淀消失且有氣泡生
成,則溶液中含有CO32-。
三、化學(xué)肥料
農(nóng)作物的生長(zhǎng)需要N、P、K等營(yíng)養(yǎng)元素。含有這些元素的某些物質(zhì)可以作為肥料。通過(guò)化學(xué)加工生產(chǎn)的肥料,稱作化學(xué)肥料。
1、常用的肥料:
化學(xué)肥料:氨氣(NH3·H2O)、碳酸氫銨(NH4HCO3)、硫酸鉀(K2SO4)、磷礦粉[主要成分磷酸鈣Ca3(PO4)2]、硫酸銨[(NH4)2SO4]、尿素[CO(NH2)2]、硝酸鉀(KNO3)、磷酸二氫銨(NH4H2PO4)。
農(nóng)家肥料:如廄肥、人糞尿、綠肥等。
2、各種肥料的功效(鉀抗倒伏磷抗旱(寒),葉片發(fā)黃要用氮)
氮肥作用:促進(jìn)植物莖、葉生長(zhǎng)茂盛、葉色濃綠(促苗); 缺氮:葉黃
鉀肥作用:促使作物生長(zhǎng)健壯、莖桿粗硬,抗倒伏(壯稈); 缺鉀:葉尖發(fā)黃,易倒伏
磷肥作用:促進(jìn)植物根系發(fā)達(dá),穗粒增多,飽滿(催果); 缺磷:生長(zhǎng)遲緩,產(chǎn)量降低,根系不發(fā)達(dá)。
3、氮、磷、鉀三種化肥的區(qū)別方法

4、銨態(tài)氮肥與堿混合加熱,或者研磨,都有氨氣放出:(反應(yīng)實(shí)質(zhì):NH4+ + OH- = NH3↑ + H2O)
(NH4)2SO4 + 2NaOH = Na2SO4 + 2NH3↑+ 2H2O;
2NH4NO3 + Ca(OH)2 = Ca(NO3)2 + 2NH3↑+2H2O;
氨氣有刺激性氣味,能使?jié)駶?rùn)的紅色石蕊試紙變藍(lán),這些可用于銨態(tài)氮肥的檢驗(yàn)。
NH4+的檢驗(yàn):加堿研磨,聞氣味。
試劑:堿(NaOH、Ca(OH)2等)、濕潤(rùn)的紅色石蕊試紙
0
酸堿鹽的基礎(chǔ)知識(shí)很多,很零碎,但是考試的題目綜合性就比較強(qiáng),所以知識(shí)點(diǎn)的串通是非常有必要的,有助于加深學(xué)習(xí)。
★單質(zhì)、氧化物、酸、堿、鹽的相互關(guān)系
(1)金屬單質(zhì)+酸=鹽+氫氣(置換反應(yīng))
1.鋅和稀硫酸:Zn+H 2SO4 = ZnSO4+H 2↑(實(shí)驗(yàn)室制取氫氣,最常用)
(實(shí)驗(yàn)室制H2用的金屬有Zn,Fe,Mg,Al,酸有稀H2SO4和稀HCl,而Mg和Al反應(yīng)太快,生成的氫氣不易收集。)
(2)金屬單質(zhì)+鹽(溶液)= 另一種金屬+另一種鹽
2.鐵和硫酸銅溶液反應(yīng):Fe+CuSO4=FeSO4+Cu(古代的“濕法冶金”);
3.鋁和硝酸銀溶液反應(yīng):Al+3AgNO3 = Al(NO3)3 + 3Ag;
(3)堿性氧化物(金屬氧化物)+酸 = 鹽+水(屬于復(fù)分解反應(yīng))
4.氧化鐵和稀硫酸反應(yīng):Fe2O3+3H2SO4=Fe2(SO4)3+3H2O(硫酸除鐵銹)
5.氧化鈣和稀鹽酸反應(yīng):CaO+2HCl = CaCl2 +H2O ;
(4)酸性氧化物(非金屬氧化物) + 堿 = 鹽+水(不是復(fù)分解反應(yīng))
6.苛性鈉暴露在空氣中變質(zhì):2NaOH+CO2 = Na2CO3 + H2O;
7.消石灰放在空氣中變質(zhì):Ca(OH)2 + CO2 = CaCO3↓+H2O;
(5)酸+堿=鹽+水(中和反應(yīng)) 基本反應(yīng)類型:復(fù)分解反應(yīng)
8.鹽酸和燒堿反應(yīng):HCl + NaOH = NaCl + H2O;
9.鹽酸和氫氧化鈣反應(yīng):2HCl+Ca(OH)2=CaCl2+2H2O;
10.氫氧鈉和硫酸反應(yīng):2NaOH + H2SO4=Na2SO4+2H2O;
(6)酸+鹽=另一種酸+另一種鹽
11.大理石與稀鹽酸反應(yīng):CaCO3+2HCl=CaCl2+H2O+CO2↑(實(shí)驗(yàn)室制CO2);
12.碳酸鈉與稀鹽酸反應(yīng):Na2CO3 +2HCl=2NaCl+H2O+CO2↑;
13.硫酸和氯化鋇溶液反應(yīng):H2SO4+BaCl2=BaSO4↓+2HCl;
(7)堿+鹽=另一種堿+另一種鹽
14.氫氧化鈣與碳酸鈉:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;
15.硫酸銅溶液與氫氧化鋇:CuSO4+Ba(OH)2=BaSO4↓+Cu(OH)2↓;
(8)鹽+鹽 = 新鹽 + 新鹽
16.氯化鈉溶液和硝酸銀溶液:NaCl + AgNO3 = AgCl↓ + NaNO3
17.硫酸鈉和氯化鋇:Na2SO4+BaCl2 = BaSO4↓ + 2NaCl;
☞再次強(qiáng)調(diào):
復(fù)分解反應(yīng)必須生成沉淀,氣體或水生成才能發(fā)生,且生成物的元素化合價(jià)不變。
歡迎使用手機(jī)、平板等移動(dòng)設(shè)備訪問(wèn)中考網(wǎng),2025中考一路陪伴同行!>>點(diǎn)擊查看